Uno studio osservazionale retrospettivo sui casi di osteosarcomi trattati con una multiterapia: il razionale e l’efficacia – A retrospective observational study on cases of osteosarcomas treated with a multitherapy: The rationale and effectiveness.
Codice: MDB005
Autore: Di Bella et al.
Data: 2022
Rivista: Neuroendocrinology Letters 43(3): 173-179
Argomento: dati clinici del Metodo Di Bella
Accesso libero: si
DOI: PMID: 36179729
URL: https://www.researchgate.net/publication/364343488
BLOG: https://www.metododibellaevidenzescientifiche.com/2022/11/13/mdb005-di-bella-et-al-2022/
Parole chiave: Osteosarcoma; fattore di crescita, acido retinoico; Somatostatina. melatonina; Vitamina D; D2 R agonisti; vitamina E; Prolattina
Tumore: osteosarcomi
Traduzione: totale e fedele
Punti di interesse: L’articolo riporta i risultati di uno studio osservazionale retrospettivo su 15 pazienti con diagnosi di osteosarcoma trattati con la multiterapia Metodo Di Bella. Sono stati trattati 15 casi diversi di sarcomi: 6 pazienti con osteosarcoma, 4 con condrosarcoma, 3 con sarcoma di Ewing, 4 con condrosarcoma e 2 con istiocitoma. Prima di iniziare la multiterapia, alcuni pazienti avevano metastasi, recidive o avevano subito un intervento chirurgico recente. Dieci pazienti su quindici avevano una malattia in stadio IV, 2 avevano uno stadio III, un paziente aveva uno stadio II e due pazienti avevano uno stadio I. La multiterapia somministrata consisteva in somatostatina e analogo (octreotide) acido all-trans-retinoico (ATRA), β-carotene, axeroftolo disciolto in vitamina E, vitamina D, vitamina C, melatonina (MLT), proteoglicani, glicosaminoglicani, idrossiurea e sodio butirrato. Con il trattamento su 15 pazienti, nove (60%) sono andati in remissione, uno è rimasto in condizioni stabili e cinque hanno avuto una progressione della malattia. I dati di sopravvivenza dopo la multiterapia MDB sono stati confrontati con i dati ufficiali ottenuti con altri protocolli del National Cancer Institute americano (NCI – Epidemiology and End Results Program – SEER) e sono i seguenti:
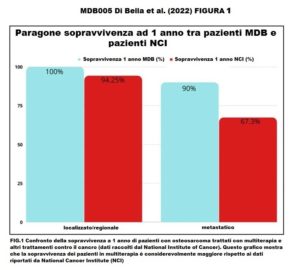
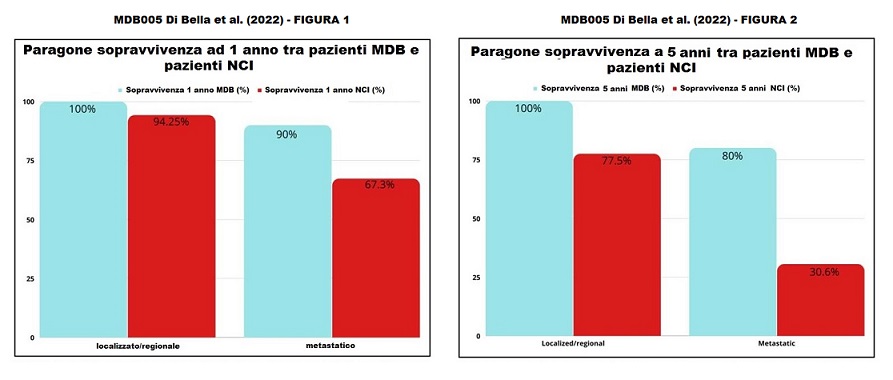
Sopravvivenza a 1 anno
- Pazienti senza metastasi (malattia regionale/locale)
- MDB 100% – dati NCI/SEER: 94%
- Pazienti con metastasi
- MDB 90% – dati NCI/SEER: 67,3%
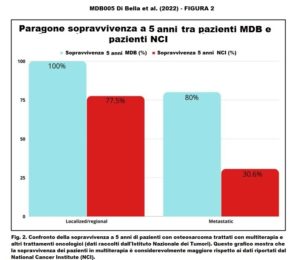
Sopravvivenza a 5 anni
- Pazienti senza metastasi (malattia regionale/locale)
- MDB 100% – dati NCI/SEER: 77,5%
- Pazienti con metastasi
- MDB 80% – dati NCI/SEER: 30,6%
Inoltre, i pazienti trattati con la multiterapia, pur manifestando una tossicità rara e temporanea di modesta entità, hanno mostrato un netto miglioramento della sopravvivenza, della risposta obiettiva e della qualità della vita.
Conclusioni: Il trattamento ha migliorato significativamente la sopravvivenza e la qualità della vita nei pazienti con sarcoma. La multiterapia si propone come un trattamento multistrategico con gli obiettivi di a) inibire l’invasività proliferativa e l’angiogenesi neoplastica, b) silenziare il sistema di sopravvivenza delle cellule staminali tumorali, c) potenziare le attività immunomodulatorie e antiossidanti, d) migliorare la vitalità e l’efficienza delle cellule normali, ed e) deprimere l’efficienza e la vitalità di quelle neoplastiche. La multiterapia crea così un’attività di contrasto alle molteplici reazioni vitali della biologia neoplastica, non prende di mira utopicamente una singola reazione vitale. Sposta inoltre l’asse terapeutico da un puro concetto citotossico – citolitico e di eradicazione illusoria di tutte le cellule tumorali, alla graduale riconversione fisiologica delle funzioni vitali deviate da cancro, equilibrando l’omeostasi immuno – neuroendocrina e riprogrammando le cellule staminali del cancro per una completa differenziazione.
Traduzione articolo
Riassunto
CONTESTO: La prognosi dei pazienti con osteosarcoma in molti casi rimane scarsa e l’aspettativa di vita con metastasi polmonari è di circa 12 mesi. La chemioterapia e la radioterapia possono controllare solo temporaneamente la progressione neoplastica, seguita dallo sviluppo di tumori chemio e radioresistenti.
METODI: Questo è uno studio osservazionale retrospettivo su 15 pazienti con diagnosi di osteosarcoma e trattati con un approccio multiterapico. La multiterapia consisteva in somatostatina e analogo (octreotide) acido all-trans-retinoico (ATRA), β-carotene, axeroftolo disciolto in vitamina E, vitamina D, vitamina C, melatonina (MLT), proteoglicani, glicosaminoglicani, idrossiurea e sodio butirrato.
RISULTATI: Questa multiterapia ha aumentato il tasso di sopravvivenza e la qualità della vita, senza tossicità manifesta, rispetto al trattamento standard per gli osteosarcomi. Gli agenti in questo approccio hanno diverse funzioni. Esercitano caratteristiche antiproliferative, antiangiogeniche, citostatiche, antiossidanti, antimetastatiche e immunomodulanti. Inoltre, l’inclusione di ATRA, MLT e butirrato di sodio ha rafforzato le proprietà antitumorali sulle cellule staminali del cancro. Inoltre, il dosaggio metronomico di idrossiurea non citolitico e non citotossico ha aumentato l’esito della terapia biologica rafforzando la capacità antitumorale.
CONCLUSIONI: Questo approccio multiterapico è efficace contro l’osteosarcoma.
INTERPRETAZIONE: Le multistrategie di questa terapia multiterapica inibiscono l’invasività proliferativa e l’angiogenesi neoplastica, silenziando il sistema di sopravvivenza delle cellule staminali tumorali, potenziando le attività immunomodulatorie e antiossidanti, migliorando la vitalità e l’efficienza delle cellule normali e deprimendo l’efficienza e la vitalità delle cellule neoplastiche.
Abbreviazioni: ATRA – Acido tutto trans retinoico ;CCK – Colecistochinina; CSC – Cellule staminali del cancro; EGF – Fattore di crescita epidermico; EGFR – Recettore del fattore di crescita epidermico; FGF – Fattore di crescita fibroblastica; GF – Fattore di crescita; GH – Ormone della crescita; GHR – Recettore dell’ormone della crescita; HGF – Fattore di crescita degli epatociti; IGF1-2 – Fattore di crescita simile all’insulina 1-2; IGFR – Recettore del fattore di crescita insulino-simile; MLT – Melatonina; PDGF – Fattore di crescita derivato dalle piastrine; PRL – Prolattina; SST – Somatostatina; VEGF – Fattore di crescita endoteliale vascolare; VIP – Peptide intestinale vasoattivo
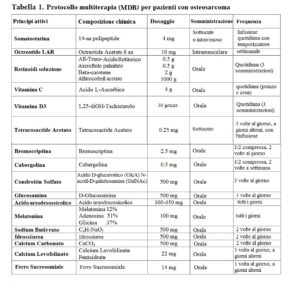
INTRODUZIONE L’osteosarcoma è un tipo aggressivo di cancro con risposte terapeutiche limitate ai protocolli oncologici. L’osteosarcoma è sporadico, idiopatico e correlato a difetti genetici ed epigenetici. I difetti genetici che portano allo sviluppo dell’osteosarcoma sono suddivisi in difetti cariotipici semplici o complessi. Semplici difetti cariotipici consistono in traslocazioni cromosomiche specifiche della malattia che portano a funzioni geniche (e proteiche) anormali, facilitando lo sviluppo del sarcoma. I sarcomi associati a semplici difetti del cariotipo includono il sarcoma di Ewing. Gli osteosarcomi con difetti cariotipici complessi possono essere secondari alla radioterapia (Arlen, 1971; Henderson et al. 2007; Hui, 2016). Uno studio su pazienti con diagnosi di sarcoma indotto da radioterapia ha dimostrato che sono unici nella loro epidemiologia e nelle caratteristiche del tumore. Gli osteosarcomi sono trattati principalmente con chemioterapia neoadiuvante, resezione chirurgica e chemioterapia adiuvante. La radioterapia viene utilizzata meno frequentemente e viene generalmente applicata quando altri trattamenti non possono ottenere risultati significativi (Mirabello et al. 2011; Rosenberg, 2017). Il sito principale di metastasi negli osteosarcomi è il polmone. Nella malattia metastatica, la sopravvivenza è generalmente scarsa. Pertanto, è necessaria una nuova strategia innovativa per il trattamento dell’osteosarcoma (Callesen et al. 2021). Di seguito, presentiamo uno studio osservazionale retrospettivo su pazienti con osteosarcoma che hanno ricevuto un protocollo di terapia multiterapica (metodo Di Bella; MDB) (Tabella 1). Questa terapia multiterapica consiste in somatostatina e analogo (octreotide) acido tutto transretinoico (ATRA), β-carotene, axeroftolo disciolto in vitamina E, vitamina D, vitamina C, melatonina (MLT), proteoglicani, glicosaminoglicani, idrossiurea e sodio butirrato. In questo report mostriamo l’efficacia della nostra multiterapia rispetto al protocollo terapeutico standard. Inoltre, discuteremo il razionale di ciascun agente del nostro approccio multiplo nella lotta contro le cellule tumorali e le cellule staminali tumorali (CSC) dell’osteosarcoma.
PAZIENTI E METODI Progettazione dello studio Questo studio è uno studio osservazionale e retrospettivo su quindici pazienti con osteosarcoma. Dopo aver fornito a ciascun paziente una sintesi su questo trattamento, ogni paziente ha approvato l’iscrizione allo studio e ha firmato un consenso informato.
Trattamento Multiterapico: Il Metodo Di Bella
Il trattamento applicato è il Metodo Di Bella (MDB) su questi pazienti che prevede la somministrazione di diversi farmaci, biologici, vitamine e integratori (Tabella 1) (Di Bella et al. 1979a; Di Bella et al. 1979b). Il MDB consiste nella somministrazione di diverse molecole specifiche in cui ciascuna molecola viene scelta in base al suo meccanismo d’azione contro le cellule tumorali, le cellule staminali tumorali (CSC), proliferazione e apoptosi, oncogeni, angiogenesi, analisi molecolare e mutazione genetica. Inoltre, alcune molecole sono state scelte per i loro meccanismi di conservazione sulle cellule sane, tra cui l’integrità della membrana cellulare, la conservazione del DNA e la funzione mitocondriale (Di Bella 2022).
Raccolta dati
Alla prima visita è stata raccolta tutta la storia medica di ciascun paziente, inclusi test diagnostici, immagini e risultati di laboratorio. Dopo l’introduzione del MDB, i pazienti sono stati monitorati per diversi anni e i dati sono stati documentati.
RISULTATI Casi clinici Abbiamo trattato 15 casi di diversi tipi di sarcomi: 6 pazienti con osteosarcoma, 4 con condrosarcoma, 3 con sarcoma di Ewing, 4 con condrosarcoma e 2 con istiocitoma (Tabella 2). Lo stadio e il grado di ciascun caso al momento della diagnosi sono presentati nella Tabella 2. Prima di iniziare la multiterapia, alcuni pazienti avevano metastasi, recidive o avevano subito un intervento chirurgico recente. Dieci pazienti su quindici avevano una malattia in stadio IV, 2 avevano uno stadio III, un paziente aveva uno stadio II e due pazienti avevano uno stadio I (Tabella 2).
Terapia MDB e sopravvivenza Dopo che i pazienti sono stati trattati con MDB, ogni paziente è stato monitorato per diversi anni. Su 15 pazienti, nove (60%) sono andati in remissione, uno è rimasto in condizioni stabili e cinque hanno avuto una progressione della malattia. Degli ultimi cinque pazienti, tre sono morti (Tabella 2). Dei pazienti che sono morti, un paziente è morto entro un anno dall’inizio del MDB e aveva metastasi epatiche e polmonari. Un altro paziente è morto dopo un anno e aveva già una recidiva renale, e il terzo paziente è morto dopo dodici anni. I dati di sopravvivenza dopo la multiterapia MDB hanno mostrato che tutti i pazienti (100%) con malattia localizzata/regionale sono sopravvissuti per più di cinque anni. La sopravvivenza a 5 anni secondo i dati del Surveillance, Epidemiology and End Results Program (SEER) è 77,5% (Tabella 3). Inoltre, secondo i dati di SEER (www.seer.cancer.gov) (Fig. 1-2), la sopravvivenza a 5 anni per i pazienti con malattia metastatica è del 30,6%, mentre per i pazienti metastatici trattati con la multiterapia MDB la sopravvivenza a 5 anni è stata del 80%. Inoltre, i pazienti trattati con la multiterapia, pur manifestando una tossicità rara e temporanea di modesta entità, hanno mostrato un netto miglioramento della sopravvivenza, della risposta obiettiva e della qualità della vita.
DISCUSSIONE: IL RAZIONALE Il presente studio dimostra l’efficacia dell’approccio multiterapico rispetto ai protocolli terapeutici standard per l’osteosarcoma. Questa multiterapia utilizza agenti per prevenire la proliferazione delle cellule tumorali e componenti che inducono la differenziazione delle cellule staminali tumorali (CSC), l’immunomodulazione e hanno funzioni antiossidanti. Questa terapia supporta e potenzia le reazioni significative e l’omeostasi antitumorale, aiutandole a contrastare l’insorgenza della neoplasia e la sua progressione (Di Bella, 2010). La terapia MDB persegue questo obiettivo attraverso formulazioni e criteri innovativi per l’uso della melatonina (complessata con adenosina e glicina), dei retinoidi solubilizzati in vitamina E e delle vitamine C, D3 e componenti della matrice extracellulare (ECM). L’inserimento di componenti polari come il β-carotene e la vitamina E tra i fosfolipidi di una membrana cellulare la stabilizza, preservandola dal danno ossidativo e dai radicali liberi (Shklar & Schwartz, 1996; Di Bella, 2005; Watters et al. 2009). Non è un caso che una percentuale significativa di sarcomi ossei aggressivi si manifesti nei bambini e nei giovani in età prepuberale e puberale perché il picco dell’ormone della crescita (growth hormone – GH) e il picco negativo della melatonina coincidono. Le cellule nelle zone di crescita ossea hanno la più alta espressione del recettore del GH. Un aumento dell’incidenza di osteosarcomi è documentato anche nei soggetti più alti della media (Mirabello, 2011). Vi è una chiara e crescente conferma del ruolo primario del GH negli osteosarcomi (Mirabello et al. 2011). Quest’ultimo studio ha documentato che i soggetti con peso alla nascita elevato (≥4.046 kg) avevano un rischio maggiore di osteosarcoma rispetto al peso medio alla nascita (2.665-4.045 kg) (OR 1,35, IC 95% 1,01-1,79). Gli individui più alti della media (51-89° percentile) e gli individui molto alti (≥90° percentile) avevano un rischio aumentato di osteosarcoma (OR 1,35, IC 95% 1,18-1,54 e OR 2,60, IC 95% 2,19-3,07, rispettivamente ; P< 0..0001) (Mirabello et al. 2011; Di Bella et al. 2018). Inoltre, la significativa diminuzione della melatonina dopo i 3-5 anni di età in coincidenza con un aumento del picco di GH è ampiamente documentata nei bambini con osteosarcoma (Cavallo, 1993; Lu et al. 2019). La sintesi proteica e la proliferazione cellulare sono strettamente dipendenti dall’interazione della prolattina con GH (Lincoln et al. 1998; Friend, 2000; Barnett, 2003), e sulle molecole mitogeniche, fattori di crescita dipendenti dal GH che ne sono positivamente regolati, come EGF, FGF, HGF, IGF1, VEGF, PDGF così come fattori di crescita gastrointestinale come VIP e CCK (Murray et al. 2004; Hagemeister e Sheridan, 2008). I recettori GH e PRL sono co-espressi sulle membrane cellulari e dimerizzano, amplificando la trasduzione delle vie di segnalazione proliferativa (Kelly et al. 1993). Numerosi studi indicano come questi ormoni ipofisari svolgano un ruolo cruciale nello sviluppo e nella progressione dei tumori umani. La loro espressione di recettori è onnipresente (Batra et al. 1997; Cameron et al. 1979) e particolarmente elevata nel tessuto canceroso. Una relazione dose-dipendente tra l’espressione del recettore GH-PRL e i processi di induzione e progressione del tumore viene rilevato istochimicamente e attraverso tecniche di immunoistochimica, Western Blot, ibridazione in situ e tecniche qPCR. La documentazione di concentrazioni di GHR molto più elevate nei tessuti tumorali rispetto ai tessuti normali e peritumorali conferma il suo potente ruolo mitogeno (Lincoln et al. 1998; Friend, 2000). Nei vari sarcomi, la percentuale crescente di cellule staminali tumorali rapportata ai diversi fenotipi neoplastici è molto probabilmente la ragione principale per cui questi tumori acquisiscono rapidamente resistenza alla chemio e alla radioterapia, diventano molto aggressivi e progrediscono rapidamente. Inoltre, la comprensione della biologia delle cellule staminali del sarcoma ha migliorato la multiterapia MDB (Hatina et al. 2019). Per questi motivi, abbiamo gradualmente aumentato le dosi di molecole documentate nella letteratura scientifica per regolare negativamente le CSC, come MLT, ATRA e glucoasmina che migliorano la differenziazione e la riprogrammazione delle cellule staminali tumorali regolando negativamente la proliferazione, l’invasività e la resistenza. Inoltre, la modifica dei criteri e delle modalità di somministrazione di farmaci alchilanti, come l’idrossiurea, ha consentito un migliore controllo della proliferazione e dell’invasività delle cellule tumorali (Di Bella & Gualano 2006; Di Bella et al. 2013; Di Bella L & Di Bella G, 2015). La somministrazione concomitante di butirrato di sodio crea un contesto epigenetico di rilassamento della cromatina, essenziale per l’interazione con i fattori di trascrizione e recettori co-espressi sulle membrane nucleari e coinvolti nei processi di differenziazione. I componenti differenzianti della multiterapia, come la soluzione di retinoidi in vitamina E, vitamine C, D e MLT, contrastano la capacità mutagena delle cellule tumorali in base al sistema di difesa delle cellule tumorali e al programma di sopravvivenza delle cellule tumorali. Le prime forme di vita, i procarioti, sono sopravvissute fino ai giorni nostri perché, evolvendosi, si sono dotate di un sistema di difesa basato su un programma di mutazioni, che ha permesso loro di riparare i danni al DNA causati da vari eventi avversi. I procarioti hanno trasmesso il programma di sopravvivenza ai batteri, che a loro volta lo hanno trasferito alle cellule somatiche. Radman ha identificato e studiato questo programma di sopravvivenza e difesa trasferito dai procarioti agli eucarioti e da questi ultimi alle cellule somatiche. Per le sue funzioni e lo scopo di sopravvivenza in condizioni di emergenza, lo chiamò il “programma SOS”, a cui le cellule somatiche accedono per superare situazioni critiche (Radman, 1975). Le cellule tumorali in una situazione di stress acuto implementano sistemi di riparazione del DNA ed esprimono o silenziano i geni in base alle loro esigenze, selezionando e conservando per ogni mutazione una serie di vantaggi in modo molto più rapido ed efficiente rispetto alle cellule batteriche. Israel (1996) ha studiato il sistema SOS, identificando numerose omologie geniche tra cellule neoplastiche e batteriche. Il sistema SOS consente alle popolazioni neoplastiche di diventare progressivamente refrattarie a vari trattamenti oncoterapici attraverso riparazioni del DNA e ricombinazioni genetiche. Nel corpo umano, in condizioni stabili e biologicamente equilibrate, il sistema SOS è silenziato e inattivo, bloccato da un repressore trascrizionale, la proteina LEX-A. Quando il DNA di una cellula somatica è gravemente danneggiato, per accedere al percorso di sopravvivenza SOS e riparare il DNA, la cellula disattiva il repressore trascrizionale LEX-A utilizzando il regolatore positivo REC-A. L’espressione di SOS avvia così una serie di mutazioni che riparano ma allo stesso tempo modificano il DNA, avviando il processo di cancerogenesi. La cellula mutata inizia un’involuzione tumorale, selezionando e trattenendo continuamente, con una progressione predefinita dal programma SOS come confermato da Lambert et al. (2011).
Più recentemente, altri tra cui Russo et al. (2019) hanno mostrato che vari meccanismi contro le cellule tumorali, anche al di là della chemio e della radioterapia, come gli anticorpi monoclonali e gli inibitori delle vie di segnalazione mitogeniche del ligando come EGFR, VEGF, IGF1, FGF, ecc., possono attivare rapidamente il sistema SOS e grandi numero di molteplici meccanismi di sopravvivenza.
CONCLUSIONI Questo studio ha analizzato 15 casi di osteosarcoma trattati con multiterapia. Il trattamento ha migliorato significativamente la sopravvivenza e la qualità della vita nei pazienti con sarcoma. La multistrategia di questa terapia multiterapica sono a) inibire l’invasività proliferativa e l’angiogenesi neoplastica, b) silenziare il sistema di sopravvivenza delle cellule staminali tumorali, c) potenziare le attività immunomodulatorie e antiossidanti, d) migliorare la vitalità e l’efficienza delle cellule normali, ed e) deprimere l’efficienza e la vitalità di quelle neoplastiche. La multiterapia estende così l’attività di contrasto alle molteplici reazioni vitali della biologia neoplastica e sposta l’asse terapeutico da un puro concetto citotossico-citolitico e di eradicazione illusoria e utopistica di tutte le cellule tumorali, alla graduale riconversione fisiologica delle funzioni vitali deviate da cancro.
File pdf della traduzione dell’articolo MDB005 “Uno studio osservazionale retrospettivo sui casi di osteosarcomi trattati con una multiterapia: il razionale e l’efficacia – A retrospective observational study on cases of osteosarcomas treated with a multitherapy: The rationale and effectiveness”. Neuroendocrinology Letters, 43(3): 173-179.
 Loading...
Loading...