Il sinergismo di somatostatina, melatonina, retinoidi, vitamin E, D3, C, inibitori prolattinici ed estrogenici, microdosi metronomiche di ciclofosfamide, ha incrementato sopravvivenza, risposte obiettive, performance status, in 297 casi di carcinomi del seno – The Synergism of Somatostatin, Melatonin, Vitamins Prolactin and Estrogen Inhibitors Increased Survival, Objective Response and Performance Status In 297 Cases of Breast Cancer
Codice: MDB001
Autore: Di Bella et al.
Data: 2018
Rivista: Translational Biomedicine 9 No.1:146
Argomento: dati clinici Metodo Di Bella
Accesso libero: si
DOI: http://dx.doi.org/10.21767/2172-0479.100144
BLOG: https://www.metododibellaevidenzescientifiche.com/2022/05/03/mdb001-di-bella-et-al-2018/
Parole chiave: cancro al seno, somatostatina, retinoidi, inibitori della prolattina, melatonina
Tumore: tumore al seno
Traduzione: totale, fedele
Punti di interesse
Il cancro al seno è la forma più frequente di cancro nelle donne e la principale causa di morte nelle donne. Il carcinoma mammario viene solitamente trattato con un intervento chirurgico, che può essere associato singolarmente o in varie forme a chemioterapia, blocco degli estrogeni, radioterapia e anticorpi monoclonali. In questo articolo viene riportato uno studio osservazionale retrospettivo con follow-up a 5 anni, condotto su 297 pazienti affette da carcinoma mammario e trattate con la terapia biologica Metodo Di Bella. Tutti i pazienti hanno ricevuto una combinazione giornaliera di somatostatina/octreotide, melatonina, retinoidi solubilizzati in alfa tocoferolo acetato, agonisti dopaminergici, inibitori degli estrogeni e dosi minime orali di chemioterapici.
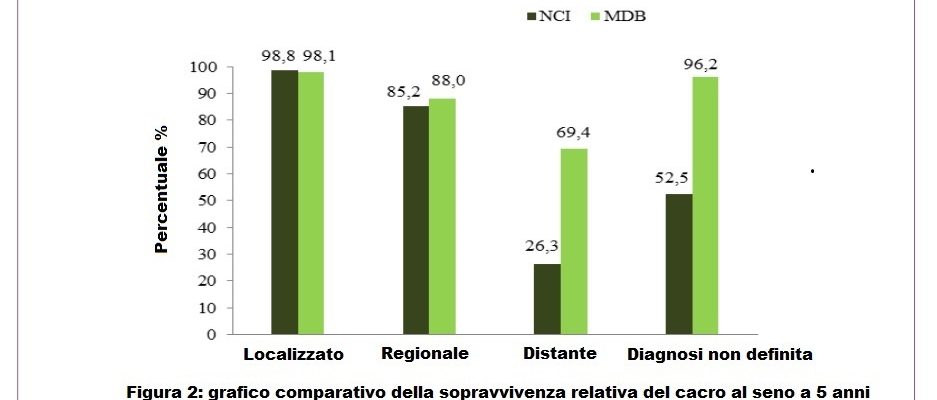
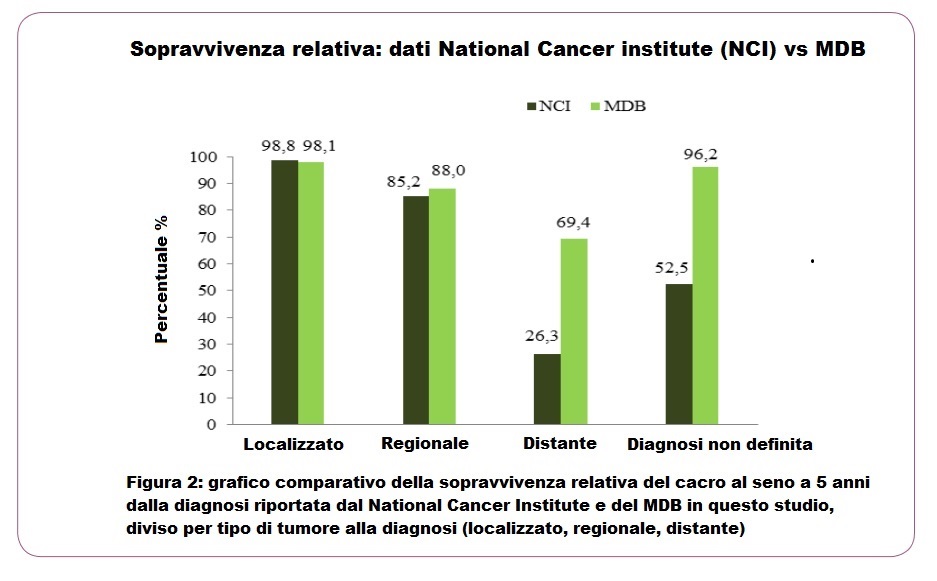
Lo studio riporta risposte obiettive complete e stabili senza chemioterapia citolitica, in alcuni casi anche senza chirurgia o radioterapia, con un miglioramento generalizzato della qualità della vita e nessuna tossicità significativa e/o prolungata. I migliori esiti clinici sono stati raggiunti, come previsto, nel primo gruppo di pazienti, quelle con carcinoma mammario regionale, con una risposta clinica di regressione sempre superiore all’80%. Nel secondo gruppo di pazienti con cancro localmente avanzato, i risultati più promettenti sono stati osservati con il MDB somministrato nella forma di seconda linea (dopo intervento chirurgico), dove l’87,5% dei pazienti ha ottenuto la regressione. Il più importante tasso di sopravvivenza a 5 anni è stato del 69,4% allo stadio IV del cancro rispetto al 26,3% riportato dal National Cancer Institute.
In una sotto analisi di 40 pazienti che hanno fatto il MDB in prima linea, senza nessuna altra terapia fatta in precedenza, si evidenzia: un beneficio clinico (risposta completa, risposta parziale, malattia stabile) nell’85% dei pazienti con malattia in stadio iniziale (I – II – IIIA), e una percentuale del 44% di risultati positivi (2 risposte parziali, e 2 stabilità di malattia) nei 9 pazienti con tumore metastatico.
l cancro al seno rimane la principale causa di morte mondiale nelle donne, per le carenze nella prevenzione e delle attuali cure. Questo evidenzia la necessità di superare i gravi limiti della terapia oncologica sfruttando tante evidenze scientifiche ancora troppo sottovalutate o non considerate.
Traduzione articolo
Riassunto
Contesto: il cancro al seno è ancora la principale causa di morte nelle donne in tutto il mondo.
Domanda di studio: Il nostro scopo è migliorare la sopravvivenza, la risposta obiettiva e la qualità della vita con una terapia biologica non tossica.
Disegno dello studio: Il Metodo Di Bella (MDB) con melatonina (MLT), retinoidi, solubilizzati in vitamina E, D3 e C, folati, proteoglicani e calcio, ha un’azione differenziante, citostatica, antiangiogenica, immunomodulante, un effetto fattorialmente sinergico perché potenzia contemporaneamente quelle funzioni che la fisiologia considera essenziali per la vita. Con la somatostatina/octreotide, la prolattina (PRL) e gli inibitori degli estrogeni, il MDB ha un effetto antiproliferativo, antiangiogenico e antimetastatico. Queste molecole governano negativamente le secrezioni ipofisarie di ormone della crescita (GH) e PRL, le cui proprietà mitogeniche sono potenziate dalla combinazione di ormoni ovarici come gli estrogeni. La regolazione negativa del GH si estende a IGF-1, EGF (Fattore di crescita epidermico), VEGF (Fattore di crescita endoteliale vascolare) e fattori di crescita GH-dipendenti. Il Metodo Di Bella utilizza dosi metronomiche minime apoptotiche, non citotossiche e non mutagene di ciclofosfamide, la cui tollerabilità è potenziata dalla melatonina e dalle vitamine incluse nel MDB. Riportiamo uno studio osservazionale retrospettivo con follow-up a 5 anni, condotto su 297 pazienti affette da carcinoma mammario e trattate con la terapia biologica Metodo Di Bella.
Risultati e conclusione: risposte obiettive complete e stabili senza chemioterapia citolitica, in alcuni casi anche senza chirurgia o radioterapia, con un miglioramento generalizzato della qualità della vita e nessuna tossicità significativa e/o prolungata. Il più importante tasso di sopravvivenza a 5 anni è stato del 69,4% allo stadio IV del cancro rispetto al 26,3% riportato dal National Cancer Institute.
Introduzione
Il carcinoma mammario viene solitamente trattato con un intervento chirurgico, che può essere associato singolarmente o in varie forme a chemioterapia, blocco degli estrogeni, radioterapia e anticorpi monoclonali selettivi per i recettori del fattore di crescita epidermico (EGFR). Il cancro al seno è la forma più frequente di cancro nelle donne e la principale causa di morte nelle donne.
Numerosi studi in vitro condotti su diverse linee cellulari hanno dimostrato i marcati effetti antitumorali dei componenti della MDB, chiarendone i meccanismi d’azione e aprendo la strada al raggiungimento di risultati incoraggianti nella pratica clinica [1-16]. Riportiamo uno studio osservazionale retrospettivo con follow-up a 5 anni, condotto su 297 pazienti affette da carcinoma mammario e trattate con la terapia biologica Metodo Di Bella.
Materiali e metodi
Criteri di arruolamento di 297 casi di cancro al seno
Sono state arruolate solo pazienti con una diagnosi istologica di cancro al seno e caratteristiche della malattia che potevano essere misurate secondo i criteri di valutazione della risposta nei tumori solidi (RECIST) [17].
Lo studio ha incluso 297 pazienti affette da cancro al seno e ognuna di queste è stata sottoposta a test ematochimici, istologici e immunoistochimici previsti per questa patologia.
Le pazienti sono state divise in tre gruppi in base allo stadio del tumore al seno all’inizio del trattamento.
• Il primo gruppo, il carcinoma mammario regionale, era costituito da pazienti il cui tumore era limitato a un singolo distretto anatomico.
• Il secondo gruppo, il carcinoma mammario locale, era costituito da pazienti il cui tumore si era diffuso ai linfonodi.
• Il terzo gruppo, carcinoma mammario avanzato, era composto da pazienti con metastasi.
Il MDB è stato somministrato in una delle seguenti forme:
1) Trattamento di prima linea, per pazienti che in precedenza avevano subito solo un intervento chirurgico
2) Trattamento di seconda linea, per i pazienti che avevano precedentemente seguito i tradizionali protocolli oncologici adiuvanti per un massimo di 6 mesi.
3) Trattamento di ultima istanza, per i pazienti con tumore in stadio IV sottoposti a ripetuti trattamenti multichemio/radioterapici da più di un anno.
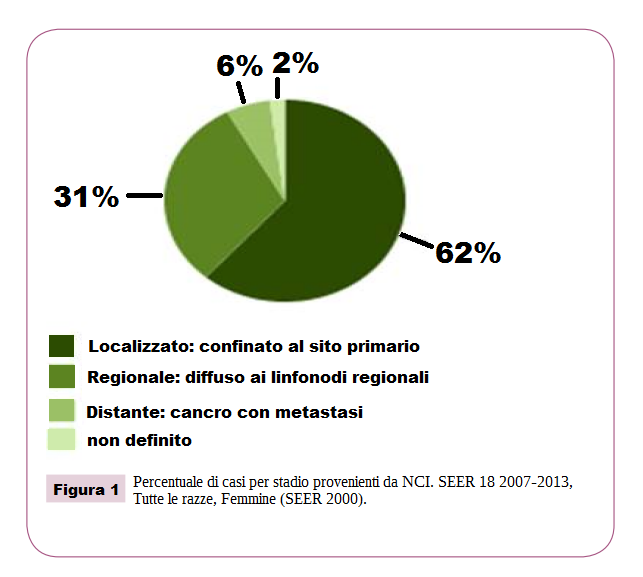
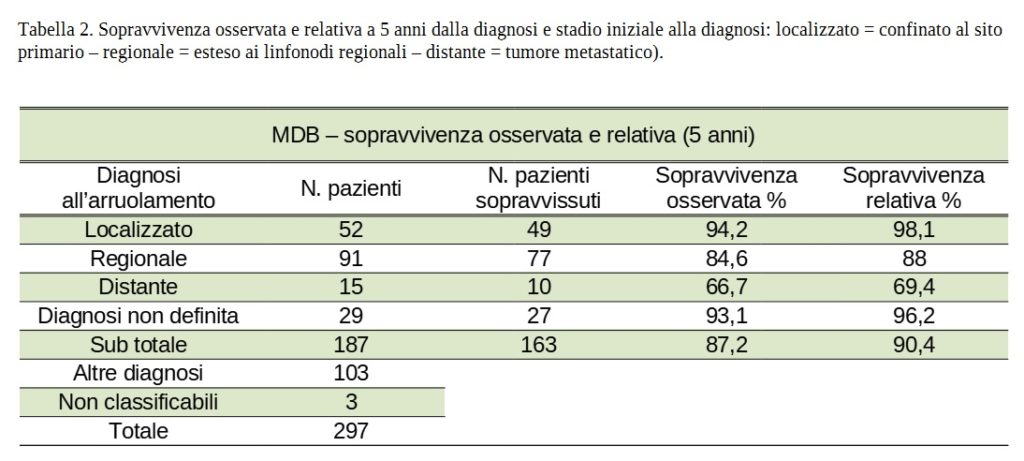
Le risposte cliniche obiettive sono state classificate statisticamente in tre gruppi: REGRESSIONE, STABILITÀ, PROGRESSIONE. Tra gli effetti del MDB sono state valutate anche la tossicità e la qualità della vita. È stata inoltre valutata la sopravvivenza RELATIVA, ovvero la percentuale di pazienti ancora in vita a 5 anni dalla diagnosi di carcinoma mammario, rispetto alla sopravvivenza media di un gruppo di donne della stessa età, della stessa area geografica, e in buona salute. Quest’ultimo indice è stato poi confrontato con i risultati pubblicati dal National Cancer Institute (Figura 1 analisi statistica dei casi per stadio), la principale agenzia americana per la raccolta e la gestione dei dati relativi ai malati di cancro (Figura 1).
Criteri di arruolamento 40 casi di cancro al seno – Sotto-analisi
È stata allestita una sotto-analisi con solo 40 casi. In questo studio solo state reclutate pazienti con uno stato 2 dell’Eastern Cooperative Oncology Group (ECOG), con diagnosi istologica di cancro al seno e con caratteristiche misurabili della malattia in accordo con i criteri di valutazione della risposta dei tumori solidi (RECIST). Un altro criterio di arruolamento era l’assenza di altri regimi terapeutici standard, e l’accettazione dopo con consenso informato del MDB come trattamento di prima linea. I 40 casi sono stati classificati in base al tipo di risposta ricevuta durante il periodo di osservazione (secondo i criteri RECIST):
• RISPOSTA GLOBALE = CR (risposta completa) – PR (risposta parziale) – SD (malattia stabile) – PD (malattia in progressione)
• DFS = sopravvivenza libera da malattia
• PFS = sopravvivenza senza progressione
Trattamento terapeutico
Tutti i pazienti hanno ricevuto una combinazione giornaliera di somatostatina/octreotide, melatonina, retinoidi solubilizzati in alfa tocoferolo acetato, agonisti dopaminergici, inibitori degli estrogeni e dosi minime orali di chemioterapici.
Questi componenti sono stati somministrati come segue:
Dosaggi orali graduali di:
• Acido retinoico, [ATRA-All Trans Retinoc Acid] 0,25 gr (488.372 UI), + axeroftolo palmitato 0,25 gr (909000 UI) + Betacarotene 1 gr (3 334 000 UI) solubilizzato in alfa tocoferolo acetato 500 gr, rapporto stechiometrico 1: 1:4:2)(1×106 UI); il digiuno, una volta al giorno per sette giorni, poi due volte al giorno per 7 giorni; dalla settimana 3 per il resto del periodo di trattamento, 3 volte al giorno, per via orale.
• Diidrotachisterolo 10 gocce per ogni somministrazione di retinoidi (15 200 UI), 30 gocce al giorno.
• Somatostatina a dosi gradualmente crescenti (1 mg per i primi 7 giorni, aumento di 1 mg per settimana, a 3 mg al giorno 21).
• Tetracosactide acetato (0,25 mg) aggiunto a giorni alterni alla siringa con somatostatina, compatibilmente con pressione e glicemia.
• Octreotide a rilascio prolungato (LAR) (20 mg) ogni 3 settimane, per via intramuscolare.
• Analoghi della triptorelina LH-FSH (ormone follicolo-stimolante) 3,75 mg ogni 4 settimane, per via intramuscolare.
• Melatonina idrosolubilizzata in legame idrogeno con Adenosina e, stabilizzata con Glicina in compresse da 5 mg, per via orale: 3 compresse (15 mg) a mezzogiorno e alla sera ai pasti più 10 compresse (50 mg) prima di coricarsi (dose media giornaliera totale= 80 mg).
• Cabergolina per via orale al pasto principale, 1 mg (pari a 1\2 compressa) due volte a settimana.
• Bromocriptina (2,5 mg) per via orale, mezza compressa mattina e sera.
• Anastrozolo compressa da 1 mg.
• Ciclofosfamide (50-100 mg) per via orale, dosaggio variabile: iniziare con 1 compressa al pasto principale per 1 settimana, poi 1 compressa al mattino e alla sera un giorno e il giorno successivo solo la sera.
• Idrossiurea 500-1000 mg/giorno; sostituirlo con Endoxan se non tollerato o se sono presenti metastasi cerebrali dovute alla capacità dell’idrossiurea di passare attraverso la barriera ematoencefalica.
• Acido Ascorbico (Vit C) per via orale: 1/2 cucchiaino (4 gr) in un bicchiere d’acqua a mezzogiorno ea cena insieme a:
• Lattato di calcio gluconato + carbonato di calcio pari a 1000 mg di calcio, mezza bustina nello stesso bicchiere.
• Condroitin solfato (500 mg) una compressa al mattino, a mezzogiorno e alla sera, ai pasti.
• Solfato ferroso (329,7 mg) una compressa 2 – 3 volte a settimana, a seconda dei valori di sideremia ed emocromo.
• Calcio levofolinato una compressa da 22 mg al giorno.
• Acido ursodesossicolico (UDCA) 300 mg per contrastare l’inibizione coleretica e colagogica della SST (Somatostatina) e/o dell’octreotide.
• Taurina 1500-2000 mg/die quando necessario, per migliorare la funzionalità cardiaca ed epatica.
Il trattamento terapeutico è stato somministrato in modo continuativo, anche dopo la completa remissione, e i suoi effetti sono adeguatamente e costantemente monitorati nel tempo, attraverso la chemioterapia e con l’ausilio della diagnostica strumentale.
Finché il tumore è in corso, la terapia va somministrata senza alcuna variazione, o con le eventuali modifiche che si possono apportare sul decorso, e solo dopo aver ottenuto una completa remissione nel tempo può essere opportunamente ridotta in maniera molto graduale fino a raggiungere una soglia terapeutica di “mantenimento”, calibrata anche sulla base della stadiazione individuale e delle caratteristiche istologiche.
Valutazione della sicurezza e della tossicità
Per la valutazione della tossicità sono stati considerati solo gli effetti collaterali che avrebbero potuto essere dovuti a questo specifico trattamento. Tutti i pazienti hanno quindi dato il loro consenso informato a partecipare allo studio.
I fenomeni di tossicità più frequenti riscontrati nello studio, di grado I e II, sono stati i seguenti:
• Tossicità ematologica: Leucopenia 33%,
• Gastrointestinale: nausea 25%,
• Sonnolenza (36%).
Questi fenomeni sono stati gli unici osservati, e generalmente si è verificato un successivo, progressivo e graduale adattamento e miglioramento nell’arco di poche settimane. Una riduzione, un ritardo o una sospensione temporanea del trattamento a causa della tossicità è stata necessaria nei pazienti con leucopenia (sospensione di ciclofosfamide fino al recupero della conta leucocitaria) e nei casi di gravi effetti gastrointestinali (somatostatina). Tali circostanze, sebbene limitate, si sono verificate molto più frequentemente e più chiaramente, soprattutto in pazienti in stadio critico, avanzato soprattutto se pretrattati con chemioterapia, radioterapia, anticorpi monoclonali.
Non ci sono stati decessi associati al trattamento.
Risultati e discussione
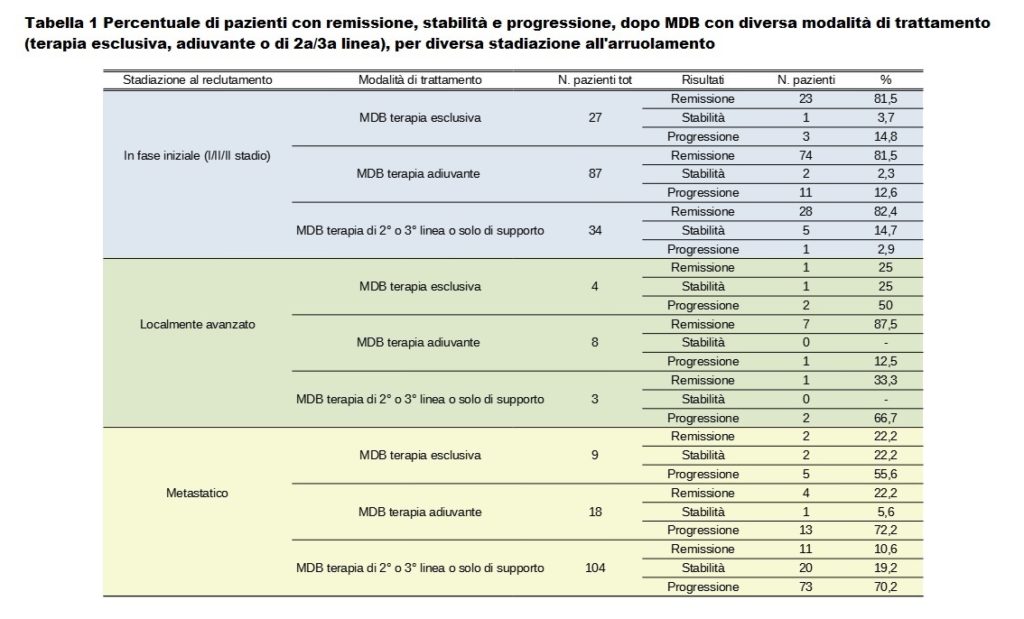
La tabella 1 mostra il risultato clinico in termini di REGRESSIONE, STABILITÀ e PROGRESSIONE della malattia. I migliori esiti clinici sono stati raggiunti, come previsto, nel primo gruppo di pazienti, quelle con carcinoma mammario regionale, con una risposta clinica di regressione sempre superiore all’80%. Nel secondo gruppo di pazienti con cancro localmente avanzato, i risultati più promettenti sono stati osservati con il MDB somministrato nella forma di seconda linea, dove l’87,5% dei pazienti ha ottenuto la regressione. Per quanto riguarda le pazienti con carcinoma mammario in stadio avanzato, sia la prima che la seconda forma di trattamento hanno ottenuto una regressione nel 20% dei casi, mentre la percentuale di successo è stata solo del 10% nelle pazienti che erano state ripetutamente sottoposte a più sessioni di chemio e radioterapia, non erano più reattivi ed erano generalmente in condizioni critiche prima di iniziare il MDB (Tabella 1).
Per confrontare i nostri risultati con i dati NCI, è stata calcolata una sopravvivenza relativa preliminare per ogni stadio e riportata nella Tabella 2. Nella Figura 2 è mostrata una valutazione della percentuale di donne ancora in vita 5 anni dopo la diagnosi, trattate con il MDB, rispetto a dati sul trattamento oncologico ufficiale riportati dal National Cancer Institute. Il metodo MDB sembra più efficiente in particolare per il trattamento del tumore a distanza (Tabella 2) (Figura 2).
Sottoanalisi
Questa sottoanalisi evidenzia:
• Beneficio clinico target (risposta completa, risposta parziale, malattia stabile) nell’85% dei pazienti con malattia in stadio iniziale (I – II – IIIA)
• una percentuale del 44% di risultati positivi (2 risposte parziali, e 2 stabilità di malattia) nei 9 pazienti con tumore metastatico e una sopravvivenza media di circa 30 mesi (75-42-42-41-24-21-17-6 -6).
In base ai criteri di classificazione utilizzati da N.C.I (Progetto SEER 18 – 2007-2013), i 40 casi della sottoanalisi sono classificabili:
• 19 tumori localizzati (11 risposta completa – 6 risposta parziale – 1 stablità di malattia – 1 progressione di malattia).
• 12 tumori locoregionali (5 risposta completa – 2 risposta parziale – 1 stablità di malattia – 4 progressione di malattia).
• 9 tumori metastatici (2 risposta parziale – 2 stablità di malattia – 5 progressione di malattia).
Conclusione
La terapia MDB si propone di contrastare la progressione del fenotipo neoplastico mediante:
a) inibizione della proliferazione neoplastica da parte dei processi cellulari di apoptosi/necrosi e deplezione di ormoni e fattori di crescita cellulare;
b) contrasto della marcata tendenza mutagena mediante l’attivazione diretta dei sistemi di riparazione del DNA e mediante la programmazione cellulare epigenetica.
c) blocco della progressione neoplastica riducendo la formazione di nuovi vasi sanguigni (neoangiogenesi-linfoangiogenesi) e dei fenomeni di motilità cellulare (migrazione), essenziali per la disseminazione neoplastica
d) rafforzamento dei meccanismi naturali di difesa contro l’aggressione neoplastica (immunità naturale e acquisita e miglioramento delle funzioni vitali).
Nei casi di carcinoma mammario monitorato a 5 anni, la multiterapia biologica MDB ha migliorato significativamente la qualità della vita, la risposta obiettiva e la sopravvivenza rispetto agli stessi stadi di carcinoma mammario trattati con protocolli oncologici convenzionali. La regolazione negativa dei principali sistemi mitogeni interattivi – GH–GF–Prolattina-Estrogeno – mediante somatostatina e analoghi, agonisti D2R, inibitori dell’aromatasi, analoghi dell’LHFSH, insieme all’azione differenziante, citostatica, omeostatica di Retinoidi, Vitamine E, D3 e C, Folati, Ca, MLT (Melatonina), Proteoglicani con interazione fattoriale, senza tossicità significativa, hanno reso possibile questo risultato [18-22]. Riportiamo questi risultati terapeutici per migliorare la prognosi dei tumori in generale e del cancro al seno in particolare. Il cancro al seno rimane la principale causa di morte mondiale nelle donne, a dimostrazione delle carenze delle attuali misure di prevenzione e cura del cancro e della necessità di superare questi gravi limiti della terapia oncologica sfruttando evidenze scientifiche ancora sottovalutate.
File pdf della traduzione di MDB001 Di Bella et al. (2018) “Il sinergismo di somatostatina, melatonina, retinoidi, vitamin E, D3, C, inibitori prolattinici ed estrogenici, microdosi metronomiche di ciclofosfamide, ha incrementato sopravvivenza, risposte obiettive, performance status, in 297 casi di carcinomi del seno – The Synergism of Somatostatin, Melatonin, Vitamins Prolactin and Estrogen Inhibitors Increased Survival, Objective Response and Performance Status In 297 Cases of Breast Cancer”. Translational Biomedicine 9 No.1:146





